Lösungen Kapitel 10
From BioPhy.de Wiki
Aufgabe 10.1:
Lipid Monofilme:
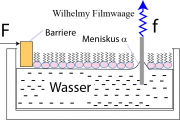
(i) Messung des Drucks mittels Wilhelmy Filmwaage: Diese besteht in der Regel aus einem Platinplättchen, das in den Trog eintaucht. Es wird durch Kapillarkraft aus dem Wasser gezogen. Die auf das Filterpapier wirkende Kraft ergibt sich aus der Balance zwischen Gravitation und Kapillarkraft (Oberflächenspannung):
Dabei sind a: Dicke; b: Breite (a << b); h die in die Subphase eingetauchte Länge des Plättchens, g die Gravitationskonstante und die Dichte der Flüssigkeit. In der Regel kann man durch Wahl der Plättchen vollständige Benetzung erreichen (
= 0° ). Durch Wahl sehr dünner Plättchen (a << b) wird a
0 und man kann auch den Auftrieb vernachlässigen. Daher folgt:
Dadurch erhält man durch Messung der Kraft direkt die Oberflächenspannung . F wird durch eine Federwaage bestimmt. Der laterale Druck p (in
gemessen) ist durch die Differenz zwischen der Oberflächenspannung des Wassers (
) und der mit der Lipidschicht bedeckten Oberfläche (s) bestimmt:
.
Der Polymorphismus monomolekularer Lipidfilme:
Lipidmonofilme sind 2D flüssigkristalline Zustände und werden durch zwei Ordnungsparametern bestimmt: Die in Orientierung der Ketten (die in Kapitel 10.3 definiert wurde) und die laterale Packung der Lipide . Aus dieser Betrachtung der Ordnungsparameter erwartet man die in der unten wiedergegebenen Abbildung 13 der Arbeit von Albrecht et al (1978) dargestellten Phasenzustände. Man beachte, dass auch die Kopfgruppen geneigt sein können, so dass auch für diese ein Orientierungs-Ordungsgrad eingeführt werden kann.
Ein Beispiel, an dem man den thermotropen Polymorphismus der Monofilme gut studieren kann, sind die einkettigen Fettsäuren. Abbildung unten zeigt das Beispiel der Palmitinsäure. Eine Besonderheit ist ist die Umwandlung zwischen dem festen Zustand mit geneigten Ketten (man nennt ihn auch smektisch BC) in den mit normal zur Oberfläche stehen Ketten. Man sieht, die Umwandlung ist im Falle der Fettsäuren von erster Ordnung. Im Ggensatz zu den Phospholipiden, bei denen dieser Übergang von zweiter Ordnung ist, wie der Einsatz b im linken Bild der Abb. 2 zeigt, der nur einen Knick bei der Umwandlungs-Temperatur zeigt.
Aufgabe 10.2:
Elektrisch induzierte Phasenumwandlungen
Vorbemerkung: Durch pH-Änderungen und Ionen induzierte Konformations- und Phasenumwandlugen von Membranen sind aus folgenden Gründen besonders interessant: (i) Sie können isotherm ablaufen und ermöglichen lokale Konformationsumwandlungen, z. B durch Adsorption geladener Proteine wie Annexine (s. Abb 9.4a und 9.b). (ii) Die Umwandlungen besitzen eine ausgeprägte Hysteresis und können möglicherweise als Kurzzeitgedächtnis fungieren (s. dazu Ergänzung am Ende)
Freie Enthalpie: G(T,p,N)=U(V,S,N) +pV -TS ;
;
Ergänzung zur Aufgabe 10.2.:
Hystersis effekte: Hystereseeffekte ladungsinduzierter Konformationsumwandlungen - Domänenbildung.
Hystereseeffekte sind ein allgemeines Phänomen bei ladungsinduzierten Umwandlungen von Membranen Proteinen oder Polyelektrolyten. Hysteresiseffekte in Polyelektrolyten wurden von A. Katchalsky untersucht, der zeiget, dass man damit isotherm arbeitende künstliche Muskeln herstellen kann (s. dazu T. Hill Statistical Thermodynamics Ch.21.4).
Hysteresiseffekte sind jedoch auch von außerordentlichem Interesse als mögliche biologische Schalter oder Kurzzeitspeicher. Ein biologisch interessantes Beispiel ist die Hysterese der pH- oder Ca-induzierten Phasenseparation in Membranen. Ein Beispiel eines in vitro Modells zeigt folgende Abbildung. In diesem Experiment wurde die Temperatur so eingestellt, dass man sich bei pH = 7 mitten in der L-L
-Umwandlung befindet. Der Bruchteil der Lipide in der festen Phase ist als Funktion des pH wiedergegeben und zwar bei steigendem und fallendem pH. Man beobachtet eine ausgeprägte Hysteresis der Umwandlung, die sich über rund 1.5 pH-Einheiten erstreckt.

Ursache der Hysteresis ist die in Kapitel 10.23 beschriebene Änderung des pH an der Oberfläche geladener Membranen. Das negative Oberflächenpotential in der fluiden Phase (zweifach negativ) ist höher als in der kristallinen Phase, in der die Lipide nur einfach geladen sind. Bei zunehmendem pH muss man also zu höheren Werten des pH im Volumen gehen, um das Lipid zu dissoziieren und damit die membran zu schmelzen. Umgekehrt muss man bei pH-Abnahme zu niedrigeren Werten des pH gehen, um die Protonen zu binden, da das negative Potential ja geringer wird.
Die durch Ca-Ionen vermittelte Hysteresis könnte bei der Fusion synaptischer Vesikel mit der präsynaptischen Membran eine wichtige Rolle spielen, die durch Ca-Einstrom getriggert werden (s. Aufgabe 9.7). Wie in Aufgabe 9.A1 gezeigt wird, bleiben die lokale Anhäufungen von der Ionen auch bestehen, wenn die Kalziumkonzentration nach der anfänglichen Erhöhung wieder auf den für Zellen im Ruhezustand typischen Wert von 10 M abfällt. Aus heutiger Sicht wird die Fusion der Vesikel mit der präsynaptischen Membran mit großer Wahrscheinlichkeit durch die Proteine SNAP und SNARE und nicht durch Ca
vermittelt (s. Kapitel 12). Ca spielt möglicherweise eine Rolle für das Verschließen der Ca-Kanäle bei hohen Ionenkonzentrationen. Die Ca-vermittelte Hysteresis könnte beispielsweise dafür sorgen, dass die Ca- Kanäle geschlossen bleiben, wenn der mittlere Ca-Spiegel nach der elektrischen Erregung wieder auf 10
M abfällt. Wegen der Hysteresis der Entbindung bleiben die Ca-Ionen auch danach noch an der an der Membran lokalisiert, bis die fusionierten Vesikel wieder von der präsynaptischen Membran abgespalten werden.